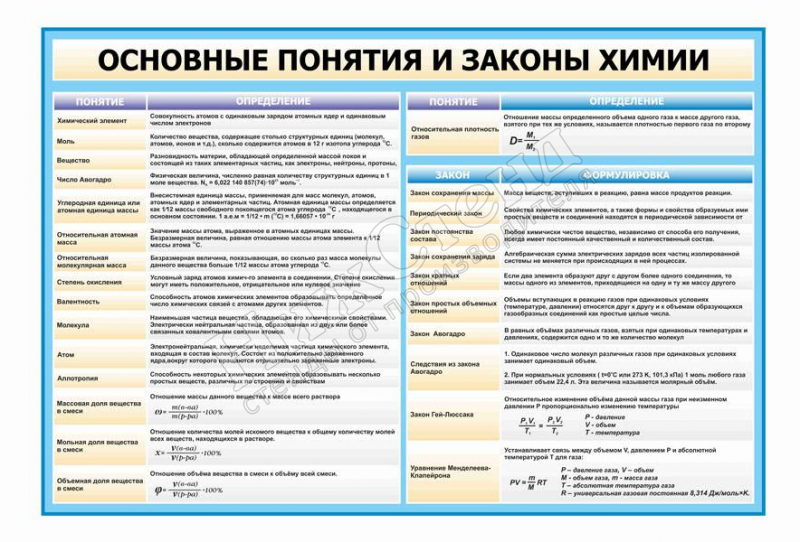
Химия — это наука, изучающая строение, состав и превращение веществ. Законы химии являются фундаментальными правилами, которые определяют химические процессы и взаимодействия веществ. Понимание основных законов химии имеет фундаментальное значение для понимания мира вокруг нас, а также для решения сложных научных и технических задач.
Один из основных законов химии — закон сохранения массы. Согласно этому закону, масса вещества не может быть создана или уничтожена в химической реакции, она может только переходить из одной формы в другую. Например, при сжигании древесины масса продуктов сгорания будет равна массе исходной древесины.
Другой важный закон химии — закон постоянных пропорций. Согласно этому закону, состав вещества всегда остается неизменным, даже при изменении массы вещества или условий реакции. Например, вода всегда будет состоять из двух атомов водорода и одного атома кислорода, независимо от массы или объема воды.
Третий важный закон химии — закон множественного соотношения. Согласно этому закону, различные вещества могут соединяться в определенных пропорциях, образуя новые вещества. Например, вода образуется путем соединения водорода и кислорода в соотношении 2:1. Этот закон позволяет предсказать и объяснить образование различных веществ и их соотношение между собой.
Закон сохранения массы и энергии
Согласно закону сохранения массы, масса всех взаимодействующих веществ до и после реакции должна быть одинаковой. Ни атомы, ни молекулы не могут исчезать или возникать из ничего. Таким образом, все вещества, участвующие в реакции, остаются в ней и не пропадают.
Закон сохранения энергии утверждает, что энергия не может быть создана или уничтожена. Она может только превращаться из одной формы в другую. В химических реакциях энергия может освобождаться или поглощаться, но общая сумма энергии до и после реакции остается неизменной.
Закон сохранения массы и энергии является фундаментальным принципом химических и физических наук. Его учет позволяет описывать и предсказывать различные реакции и процессы, а также осуществлять расчеты массы или энергии, участвующей в реакциях.
В таблице ниже приведены примеры химических реакций, соблюдающих закон сохранения массы и энергии:
| Реакция | Уравнение реакции |
|---|---|
| Горение метана | CH4 + 2O2 → CO2 + 2H2O |
| Разложение воды | 2H2O → 2H2 + O2 |
| Окисление железа | 4Fe + 3O2 → 2Fe2O3 |
Все эти реакции демонстрируют соблюдение закона сохранения массы и энергии. В каждом случае сумма массы реагентов равна сумме массы продуктов, а общая энергия в начале и конце реакции остается неизменной.
Принцип сохранения массы
Этот принцип был сформулирован Лавуазье в конце XVIII века на основе его экспериментальных наблюдений. Он стал фундаментальным законом химии и стал основой для развития дальнейших научных исследований в этой области.
Принцип сохранения массы основан на идее, что атомы являются неразрезаемыми частицами и не могут быть созданы или уничтожены в ходе химических реакций. Вместо этого, атомы переупорядочиваются и образуют новые вещества, но их общая масса остается неизменной.
Этот принцип позволяет предсказывать массу продуктов реакции на основе массы реагирующих веществ. Важно отметить, что принцип сохранения массы справедлив только для замкнутой системы, где нет потерь или приобретений массы извне.
Принцип сохранения массы часто используется в химических расчетах и стал основой для развития дальнейших законов и теорий химии. Он помогает понять, как вещества превращаются друг в друга и как можно контролировать и оптимизировать химические реакции.
Принцип сохранения энергии
Это означает, что в химических реакциях и физических процессах сумма энергии в начальном состоянии системы будет равна сумме энергии в конечном состоянии системы. Энергия может переходить из одной формы в другую, например, из механической в тепловую, электрическую или химическую и обратно, но ее общая сумма остается постоянной.
Принцип сохранения энергии помогает понять и объяснить множество физических и химических явлений. Он лежит в основе таких понятий, как законы сохранения энергии в термодинамике и законы сохранения массы в химии. Этот принцип также играет важную роль в разных областях науки и техники, включая энергетику, окружающую среду и материаловедение.
Принцип сохранения энергии является фундаментальным принципом и является одной из наиболее универсальных закономерностей природы. Его важность и широкое применение делают его неотъемлемой частью обучения и применения химических и физических наук.
Закон действующих масс
Формулировка закона действующих масс:
Скорость химической реакции пропорциональна произведению концентраций реагирующих веществ, возведенных в степени, равную их стехиометрическим коэффициентам.
Таким образом, если реакция имеет уравнение:
A + 2B → C
где A и B — реагирующие вещества, а C — продукт, то закон действующих масс будет иметь следующий вид:
скорость реакции = k[A][B]²
где [A] и [B] — концентрации реагирующих веществ, а k — коэффициент пропорциональности, называемый константой скорости.
Закон действующих масс играет важную роль в определении механизма реакции и позволяет установить зависимость между концентрацией веществ и скоростью реакции. Он является основой для расчетов реакционной скорости и использования кинетического уравнения.
Определение действующих масс
Определение действующих масс является важным шагом при решении химических задач и проведении экспериментов. Понимание действующих масс позволяет установить соотношение между составляющими реакции и использовать это знание для расчетов и прогнозирования результатов.
Для определения действующих масс в реакции необходимо знать уравнение реакции и стехиометрические коэффициенты. Стехиометрические коэффициенты – это числа перед формулами веществ в химическом уравнении, которые показывают, в каком мольном соотношении происходит реакция.
На основе стехиометрических коэффициентов можно вычислить количество вещества, участвующего в реакции, и, следовательно, его действующую массу. Для этого необходимо знать молярные массы веществ, выраженные в граммах на моль.
Определение действующих масс имеет большое значение для проведения химических расчетов, таких как расчеты массы продукта или расчеты объема газа, выделяющегося в реакции. Он также помогает в оценке эффективности процесса и оптимизации условий его проведения.
Расчет действующих масс
Действующая масса вещества, участвующего в реакции, может быть рассчитана с использованием соотношения между массой вещества и его молярной массой. Молярная масса вещества – это масса одного моля вещества, выраженная в граммах. Расчет действующих масс выполняется с учетом соотношений между массой вещества, его молярной массой и количеством вещества в реакции.
Для расчета действующей массы используется формула:
Действующая масса = масса вещества / молярная масса вещества
Например, в реакции сгорания метана (CH4), масса метана может быть выражена как 16 г, а его молярная масса равна 16 г/моль. Тогда действующая масса метана будет равна:
Действующая масса метана = 16 г / 16 г/моль = 1 моль
Таким образом, действующая масса метана в данной реакции составляет 1 моль. Расчет действующих масс веществ осуществляется с использованием аналогичных принципов и формул.
Вопрос-ответ:
Какие общие законы существуют в химии?
В химии есть несколько основных законов, таких как закон дарения и закон сохранения массы. Закон дарения гласит, что при химической реакции вещества могут обмениваться атомами или группами атомов, но суммарное количество каждого элемента остается неизменным. Закон сохранения массы утверждает, что масса реагирующих веществ равна массе образовавшихся продуктов.
Что такое закон действующих масс?
Закон действующих масс устанавливает, что скорость химической реакции пропорциональна произведению молекулярных концентраций реагирующих веществ, возведенному в соответствующие степени. Этот закон позволяет определить количественную зависимость между скоростью реакции и концентрацией реагентов в системе.
В чем заключается закон Массо-Действия?
Закон Массо-Действия устанавливает, что скорость химической реакции пропорциональна произведению концентраций реагирующих веществ, возведенному в соответствующие степени их коэффициентов в уравнении реакции. Этот закон также позволяет определить количественную зависимость между скоростью реакции и концентрацией реагентов в системе.
Как формулируется закон Бойля-Мариотта?
Закон Бойля-Мариотта устанавливает, что при постоянной температуре объем газа обратно пропорционален его давлению. То есть, если давление газа увеличивается, то его объем уменьшается, и наоборот. Это математически выражается как PV=const, где P — давление газа, V — его объем.
Что представляет собой закон Авогадро?
Закон Авогадро устанавливает, что при одинаковых условиях температуры и давления, равные объемы газов содержат одинаковое количество молекул или атомов. Этот закон также позволяет сравнивать массы разных газов.
Какие основные законы химии существуют?
Существуют несколько основных законов химии, включая закон сохранения массы, закон постоянных пропорций и закон постоянных пропорций объемов, закон Авогадро и идеального газа, закон Гей-Люссака, закон Бойля-Мариотта и многие другие.