Термодинамика – это наука, которая изучает преобразование энергии и ее соотношение с теплом и работой. Основой этой науки являются знаменитые законы термодинамики. Законы, которые описывают поведение систем, подверженных тепловым и механическим воздействиям, и помогают понять, почему наш мир работает так, как он работает.
Первый закон термодинамики, или закон сохранения энергии, гласит, что внутренняя энергия системы может меняться только за счет передачи тепла или выполнения работы. То есть энергия не может возникнуть из ниоткуда или исчезнуть. Она может только менять свою форму или передвигаться из одной системы в другую.
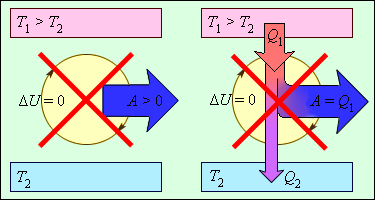
Второй закон термодинамики указывает, в каком направлении может происходить тепловое взаимодействие между системами. Он говорит, что тепло всегда переходит от более горячих объектов к более холодным. Это означает, что природа стремится уравновесить температуру в системе, и процессы, противоречащие этому закону, называются необратимыми.
Термодинамика – это фундаментальная наука, которая лежит в основе многих других областей знаний. Она позволяет нам понять и объяснить множество явлений в нашем мире, от работы двигателей до создания идеальных климатических условий. В конечном счете, законы термодинамики являются фундаментальными принципами, которые определяют поведение энергии и тепловых процессов и позволяют нам понять общие закономерности и принципы работы нашей вселенной.
Основные понятия
Первый закон термодинамики, также известный как закон сохранения энергии, утверждает, что энергия не может быть создана или уничтожена, а только преобразована из одной формы в другую. Это означает, что количество энергии в замкнутой системе остается постоянным. Закон сохранения энергии может быть записан математически: ΔU = Q — W, где ΔU представляет изменение внутренней энергии системы, Q — количество теплоты, полученной системой, а W — проделанная работа.
Второй закон термодинамики обычно формулируется в двух основных видах: утверждение о повышении энтропии и формулировка Клаузиуса. Утверждение о повышении энтропии утверждает, что энтропия изолированной системы всегда увеличивается или остается постоянной со временем. Формулировка Клаузиуса утверждает, что теплота не может самопроизвольно переходить от холодного тела к горячему телу.
Третий закон термодинамики делает утверждение о невозможности достижения абсолютного нуля (0 K), что является нижней границей температурной шкалы.
Понимание и применение законов термодинамики играют ключевую роль в различных областях науки и техники, включая физику, химию, инженерию и технологию.
Калории, джоули и термодинамические системы
Калория, обозначаемая как «cal», часто используется для измерения количества энергии, содержащейся в пище. Изначально, калория была определена как количество теплоты, необходимой для нагрева 1 грамма воды на 1 градус Цельсия. Сейчас в расчетах используется килокалория, обозначаемая как «kcal». 1 килокалория равна 1000 калориям. Мы прикидываем количество калорий, употребляемых в пищу, чтобы оценить, сколько энергии мы получаем от различных продуктов.
С другой стороны, джоуль, обозначаемый как «J», используется в системе Международной системы (СИ) для измерения энергии. Джоуль определен как количество энергии, затрачиваемой на перемещение объекта мощностью в 1 ватт в течение 1 секунды. В термодинамике джоуль часто используется для измерения работы, которую система может совершить.
Термодинамические системы состоят из путей, по которым энергия может протекать. Изменение энергии в системе можно измерить с помощью калорий или джоулей, в зависимости от контекста. Калории и джоули — это важные единицы измерения, которые позволяют нам понимать и описывать процессы, связанные с энергией в термодинамических системах.
Энтальпия и энтропия
Энтальпия (обозначается как H) определяется как сумма внутренней энергии системы и произведения давления на объем системы.
Она является функцией состояния системы и часто используется в химических реакциях для определения теплового эффекта.
Энтропия (обозначается как S) определяется как мера хаоса или неупорядоченности системы.
Эта величина также является функцией состояния системы и увеличивается в процессе нереверсибельных изменений.
Согласно второму закону термодинамики, энтропия всегда стремится увеличиваться в изолированной системе, что приводит к уменьшению ее доступной энергии.
Энтальпия и энтропия являются взаимосвязанными величинами и оказывают влияние на тепловые и химические процессы в системе.
Понимание этих концепций позволяет лучше понять поведение системы при изменении условий и использовать эту информацию для оптимизации технологических процессов и энергетических систем.
Законы термодинамики
Первый закон термодинамики, также известный как закон сохранения энергии, утверждает, что энергия не может быть создана или уничтожена, она может только переходить из одной формы в другую. Изначально сформулированный в контексте механической работы, этот закон может быть распространен и на другие виды энергии, такие как тепловая или электрическая.
Второй закон термодинамики описывает направление процессов, происходящих в закрытых системах, и вводит понятие энтропии. Согласно закону энтропии, энтропия изолированной системы всегда стремится к увеличению, и только в идеальных условиях может оставаться постоянной. Это означает, что процессы всегда действуют в сторону увеличения беспорядка и необратимы, однако существуют условия, при которых они могут быть приближенно обратимыми.
Третий закон термодинамики, известный как закон абсолютного нуля, устанавливает, что при абсолютном нуле температуры все молекулы системы находятся в состоянии минимальной энергии, а энтропия при этой температуре равна нулю. Это означает, что при достижении абсолютного нуля процессы останавливаются и система находится в стабильном, априорно известном состоянии.
Законы термодинамики играют важную роль в многих областях науки и техники, от физики и химии до инженерии и экологии. Понимание и применение этих законов помогает разрабатывать новые технологии, повышать энергетическую эффективность систем и предсказывать и контролировать процессы в различных областях.
Первый закон термодинамики: сохранение энергии
Принцип сохранения энергии утверждает, что внутренняя энергия системы может изменяться только в результате выполнения работы или передачи тепла между системой и окружающей средой. В конечном итоге, сумма энергии в системе и окружающей среде остается постоянной.
Первый закон термодинамики может быть выражен математически с помощью следующего уравнения:
Q = ΔU + W
где Q — количество тепла, переданное системе, ΔU — изменение внутренней энергии системы, W — работа, выполненная системой.
Этот закон имеет огромное значение во многих областях науки, включая химию, физику, инженерию и энергетику. Он позволяет понять, как работает тепловые двигатели, как возникает и распространяется тепло, и как происходят различные химические реакции.
Второй закон термодинамики: невозможность увеличения энтропии
А что такое энтропия? Энтропия — это мера беспорядка или неопределенности в системе. Чем выше энтропия, тем более хаотичное и беспорядочное состояние у системы. Низкая энтропия, наоборот, означает более организованное и упорядоченное состояние системы.
Второй закон термодинамики говорит о том, что процессы, которые приводят к увеличению энтропии, происходят непрерывно и необратимо. Это значит, что система сама собой не сможет вернуться к своему исходному состоянию без внешнего вмешательства.
Этот закон имеет большое значение во многих сферах, включая физику, химию, экологию и даже экономику. Он объясняет, почему невозможно создать бесплатную энергию, почему батареи разряжаются, почему мы стареем и многое другое.
Второй закон термодинамики имеет фундаментальное значение для понимания работы природы и позволяет предсказывать изменения в системе со временем. Эта концепция сложна в своей формулировке, но ее понимание является ключом к глубокому развитию физики и других наук.
Третий закон термодинамики: абсолютный нуль и непревзойденная энтропия
Понятие абсолютного нуля является теоретическим пределом, при котором вещество перестает обладать тепловой энергией и все его молекулы находятся в состоянии абсолютной покоя. Температура в этой точке равна минимально возможной и не может быть еще ниже.
Третий закон термодинамики указывает на то, что при приближении к абсолютному нулю система стремится к упорядоченному (или неразупорядоченному) состоянию с минимальной энтропией. Скорость упорядочивания системы при этом замедляется и в пределе достигает нуля. Именно поэтому абсолютный нуль недостижим в реальных системах.
Принципы, выраженные в третьем законе термодинамики, имеют широкое применение в различных областях физики и химии. Они позволяют более глубоко понять и описать явления, связанные с изменением энтропии и тепловыми взаимодействиями в различных системах.
Третий закон термодинамики, помимо своего практического значения, исследует фундаментальные вопросы о природе энтропии и ее связи с различными состояниями вещества. Несмотря на то, что абсолютный нуль недостижим, понимание его сущности и влияния на окружающий мир позволяет развивать науку и создавать новые технологии.
Вопрос-ответ:
Какие основные законы термодинамики существуют?
Существует три основных закона термодинамики: первый закон, также известный как закон сохранения энергии, второй закон, который определяет направление теплового потока, и третий закон, который описывает невозможность достижения абсолютного нуля температуры.
Что означает первый закон термодинамики?
Первый закон термодинамики, или закон сохранения энергии, утверждает, что энергия не может быть создана или уничтожена, а может только переходить из одной формы в другую или передаваться из одной системы в другую.
Какой смысл имеет второй закон термодинамики?
Второй закон термодинамики гласит, что теплота всегда переходит от объектов с более высокой температурой к объектам с более низкой температурой. Этот закон определяет направление теплового потока и объясняет, почему происходит превращение тепловой энергии в работу.
В чем заключается третий закон термодинамики?
Третий закон термодинамики утверждает, что абсолютный ноль температуры, т.е. полное отсутствие теплового движения, невозможно достичь. Этот закон устанавливает нижнюю границу для температур и имеет важное значение для понимания свойств и поведения вещества.
Какие еще законы и принципы термодинамики существуют помимо основных?
Помимо основных законов, существуют также другие принципы, такие как принцип максимальной энтропии, основанный на концепции статистической физики, и принцип эквивалентности энергии и массы, который объединяет энергию и массу как разные формы эквивалентной величины.
Что такое законы термодинамики?
Законы термодинамики — это набор основных физических законов, которые описывают поведение тепла, энергии и систем в термодинамической системе. Всего существует три основных закона термодинамики, каждый из которых является важным в понимании тепловых процессов и энергетики.